Modelo Atômico De Rutherford-Bohr – Manual da Química: mergulhe na fascinante evolução da compreensão da estrutura atômica! De modelos simplistas a teorias complexas, exploraremos a jornada científica que culminou no modelo de Rutherford-Bohr, desvendando seus postulados, limitações e impacto na física moderna. Veremos como experimentos revolucionários moldaram nossa percepção do átomo, da esfera maciça de Dalton às órbitas eletrônicas propostas por Bohr, uma verdadeira revolução no mundo da química e da física.
A viagem começa com uma análise comparativa dos modelos atômicos precedentes, destacando as contribuições de Dalton e Thomson. Em seguida, aprofundaremos no modelo de Rutherford-Bohr, examinando seus níveis de energia discretos, a relação com a absorção e emissão de energia, e a explicação do espectro de emissão do hidrogênio. Finalmente, discutiremos as limitações inerentes a este modelo e sua transição para a mecânica quântica, compreendendo como ele pavimentou o caminho para uma visão mais completa e precisa do mundo atômico.
O Modelo Atômico de Rutherford-Bohr
A compreensão da estrutura da matéria evoluiu significativamente ao longo da história da ciência, passando por modelos atômicos cada vez mais complexos e precisos. Iniciando com o modelo atômico de Dalton, simples e esférico, a ciência avançou para modelos mais sofisticados, culminando no modelo de Rutherford-Bohr, que introduziu conceitos fundamentais sobre a organização interna do átomo. Este texto detalha a evolução dos modelos atômicos, focando no modelo de Rutherford-Bohr e suas principais características.
Evolução do Modelo Atômico de Dalton para o Modelo de Rutherford-Bohr
O modelo atômico de Dalton, proposto no início do século XIX, descrevia o átomo como uma esfera maciça, indivisível e indestrutível, com propriedades características de cada elemento químico. Este modelo, embora revolucionário para a época, não conseguia explicar fenômenos como a condutividade elétrica e a emissão de raios catódicos. Posteriormente, o modelo de Thomson, conhecido como “pudim de passas”, propôs que o átomo era uma esfera de carga positiva com elétrons (partículas negativas) incrustados.
No entanto, este modelo também apresentava limitações. Os experimentos de Rutherford, utilizando o espalhamento de partículas alfa em lâminas finas de ouro, revolucionaram a compreensão da estrutura atômica.
Experimentos que Levaram à Proposição do Modelo de Rutherford
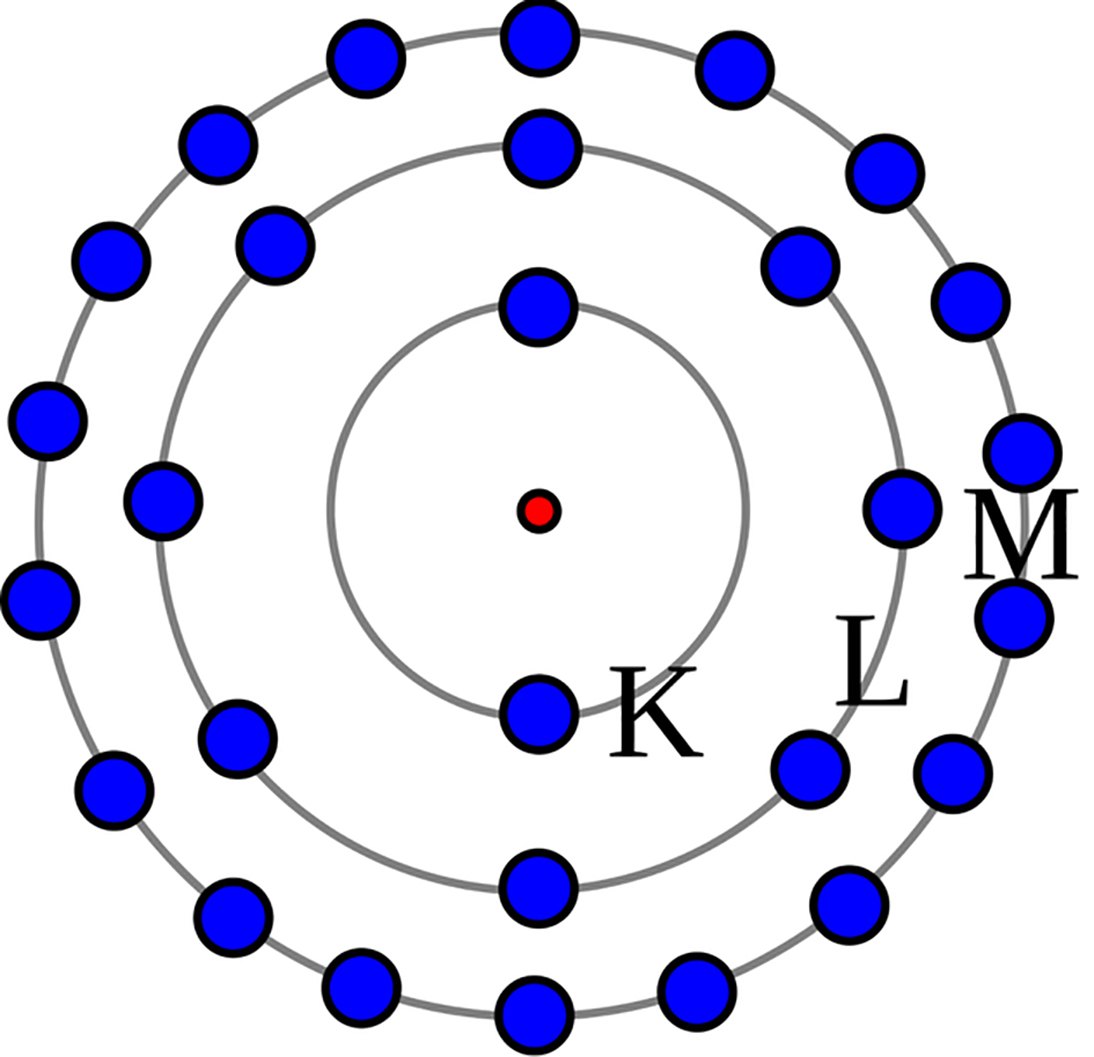
O experimento de Rutherford consistiu em bombardear uma fina folha de ouro com partículas alfa (partículas carregadas positivamente). Esperava-se que as partículas alfa atravessassem a folha de ouro com pouca ou nenhuma deflexão, de acordo com o modelo de Thomson. No entanto, os resultados foram surpreendentes: a maioria das partículas atravessou a folha sem sofrer desvio, mas algumas foram desviadas em ângulos significativos, e algumas até mesmo retornaram.
Essa observação levou Rutherford a propor um novo modelo atômico, onde a maior parte da massa e toda a carga positiva do átomo estavam concentradas em um núcleo muito pequeno, denominado núcleo atômico. Os elétrons, com carga negativa, orbitariam este núcleo em um espaço vazio muito maior.
Características do Modelo Atômico de Rutherford-Bohr
O modelo atômico de Rutherford, apesar de explicar o espalhamento das partículas alfa, apresentava uma inconsistência: de acordo com as leis da física clássica, um elétron orbitando um núcleo deveria emitir radiação eletromagnética, perdendo energia e espiralando em direção ao núcleo, colapsando o átomo. Bohr, utilizando a teoria quântica de Planck, modificou o modelo de Rutherford, propondo que os elétrons se movem em órbitas circulares específicas ao redor do núcleo, com níveis de energia quantizados.
Isso significa que os elétrons só podem ocupar determinadas órbitas, com energias definidas. A transição de um elétron de uma órbita para outra envolve a absorção ou emissão de um quantum de energia, na forma de um fóton. Este modelo explicou satisfatoriamente os espectros de emissão de átomos de hidrogênio.
Comparação entre o Modelo de Rutherford-Bohr e o Modelo Atômico de Dalton

O modelo de Dalton apresentava um átomo maciço e indivisível, enquanto o modelo de Rutherford-Bohr descreve um átomo com um núcleo denso e positivo, onde se concentra a maior parte da massa, e elétrons orbitando em níveis de energia específicos ao redor deste núcleo. O modelo de Dalton era extremamente simplificado e não conseguia explicar fenômenos elétricos e espectroscópicos, enquanto o modelo de Rutherford-Bohr, embora ainda com limitações, representa um avanço significativo na compreensão da estrutura atômica, incorporando conceitos da física quântica e explicando, em parte, o comportamento dos átomos.
Comparação dos Modelos Atômicos
| Modelo Atômico | Principais Características | Limitações |
|---|---|---|
| Dalton | Átomo esférico, maciço, indivisível e indestrutível; propriedades características de cada elemento. | Não explica fenômenos elétricos e espectroscópicos; não considera a existência de subpartículas atômicas. |
| Thomson | Átomo como uma esfera de carga positiva com elétrons incrustados (“pudim de passas”). | Não explica o espalhamento de partículas alfa; não define a localização precisa das cargas positivas. |
| Rutherford | Átomo com um núcleo pequeno, denso e positivo, onde se concentra a maior parte da massa, e elétrons orbitando em torno do núcleo. | Não explica a estabilidade do átomo; não considera os níveis de energia quantizados dos elétrons. |
| Bohr | Átomo com núcleo positivo e elétrons em órbitas circulares com níveis de energia quantizados; transições eletrônicas explicam os espectros atômicos. | Só explica satisfatoriamente o átomo de hidrogênio; não descreve adequadamente átomos com mais de um elétron. |
Níveis de Energia e Orbitais Eletrônicos no Modelo de Rutherford-Bohr: Modelo Atômico De Rutherford-Bohr – Manual Da Química
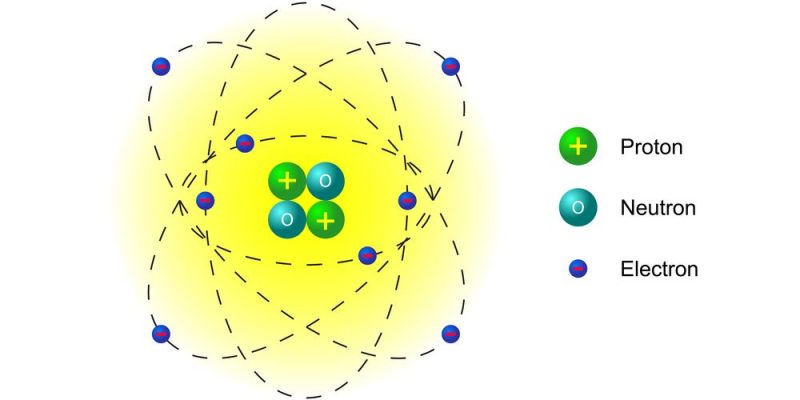
O modelo atômico de Rutherford-Bohr, apesar de suas limitações, representou um avanço significativo na compreensão da estrutura atômica, introduzindo o conceito crucial de níveis de energia quantizados para os elétrons. Este modelo, que combina o modelo nuclear de Rutherford com os princípios da física quântica de Planck, permitiu explicar, pela primeira vez, o espectro de emissão do átomo de hidrogênio, um fenômeno inexplicável pelos modelos anteriores.
O modelo de Bohr postula que os elétrons não podem ocupar qualquer órbita ao redor do núcleo, mas sim orbitas específicas, correspondentes a níveis de energia discretos. A energia de um elétron é quantizada, significando que ela só pode assumir valores específicos, e não um contínuo de valores. Cada nível de energia é representado por um número inteiro, o número quântico principal (n), sendo n=1 o nível de energia mais baixo (mais próximo do núcleo) e aumentando em valor à medida que se distancia do núcleo.
Quanto maior o valor de n, maior a energia do elétron naquele nível.
Transições Eletrônicas e Absorção/Emissão de Energia
Os elétrons podem transitar entre os diferentes níveis de energia. Para mover-se de um nível de energia inferior para um nível superior (estado excitado), o elétron precisa absorver uma quantidade específica de energia, exatamente igual à diferença de energia entre os dois níveis. Inversamente, quando um elétron retorna de um nível de energia superior para um nível inferior, ele emite energia na forma de um fóton, cuja energia é igual à diferença de energia entre os níveis.
Esta emissão de energia é responsável pela formação de espectros de emissão atômica.
Espectro de Emissão do Hidrogênio
O espectro de emissão do hidrogênio é um exemplo clássico que valida o modelo de Bohr. Quando átomos de hidrogênio são excitados (por exemplo, por aquecimento em uma chama), seus elétrons absorvem energia e saltam para níveis de energia mais altos. Ao retornarem para níveis de energia mais baixos, eles emitem fótons de luz com energias específicas, correspondentes às diferenças de energia entre os níveis.
Estas emissões produzem um espectro discreto, com linhas de cores distintas, ao invés de um espectro contínuo. A posição das linhas espectrais no espectro de emissão do hidrogênio pode ser precisamente prevista usando as equações derivadas do modelo de Bohr, confirmando a quantização da energia nos átomos.
Postulados do Modelo Atômico de Bohr
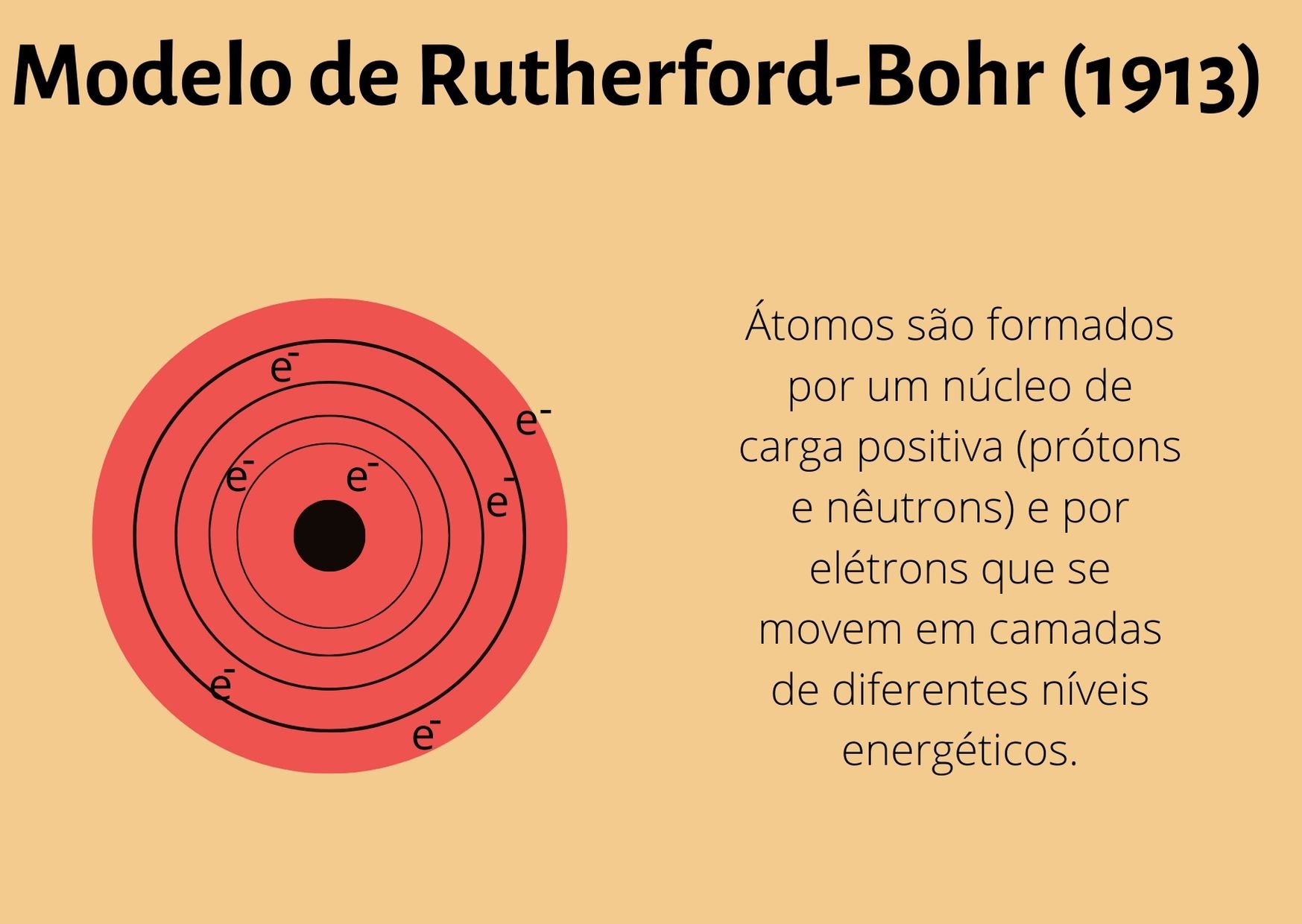
O modelo atômico de Bohr é baseado em alguns postulados fundamentais:
- Os elétrons movem-se em órbitas circulares ao redor do núcleo, sem emitir radiação.
- Apenas órbitas específicas, correspondentes a níveis de energia discretos, são permitidas.
- A energia do elétron é quantizada e relacionada ao número quântico principal (n).
- Quando um elétron transita de um nível de energia para outro, ele absorve ou emite um fóton de energia igual à diferença de energia entre os níveis.
- O momento angular do elétron em uma órbita é quantizado (mvr = nh/2π, onde m é a massa do elétron, v é a velocidade, r é o raio da órbita, n é o número quântico principal e h é a constante de Planck).
Experimento de Franck-Hertz
O experimento de Franck-Hertz, realizado em 1914, forneceu evidências experimentais diretas para a quantização de energia nos átomos. Neste experimento, um feixe de elétrons é acelerado através de um vapor de mercúrio. A energia cinética dos elétrons é gradualmente aumentada. Observa-se que a corrente elétrica através do vapor de mercúrio não aumenta continuamente com o aumento da voltagem, mas apresenta quedas abruptas em valores específicos de voltagem.
Essas quedas ocorrem quando a energia cinética dos elétrons atinge valores específicos que correspondem às diferenças de energia entre os níveis de energia do átomo de mercúrio. Quando um elétron colide com um átomo de mercúrio e possui energia suficiente para excitar um elétron do átomo para um nível de energia mais alto, ele perde toda a sua energia cinética nesse processo.
Essa perda de energia se manifesta como uma queda na corrente elétrica. A observação dessas quedas abruptas na corrente confirma a existência de níveis de energia discretos nos átomos, fornecendo forte suporte ao modelo de Bohr. Os valores de energia encontrados no experimento correspondem às diferenças de energia entre os níveis de energia do mercúrio, previstos teoricamente.
Limitações e Evolução do Modelo de Rutherford-Bohr
O modelo atômico de Rutherford-Bohr, apesar de revolucionário para a sua época, apresentava limitações significativas que impediam sua aplicação a átomos mais complexos e não conseguia explicar completamente o comportamento da matéria a nível atômico. Sua simplicidade, enquanto um avanço considerável, também se tornou sua principal falha ao confrontar-se com os resultados experimentais mais precisos que surgiram posteriormente. A compreensão dessas limitações foi crucial para o desenvolvimento da mecânica quântica, um marco fundamental na física moderna.
Limitações do Modelo de Rutherford-Bohr em Átomos Complexos, Modelo Atômico De Rutherford-Bohr – Manual Da Química
O modelo de Rutherford-Bohr, com seus elétrons orbitando em níveis de energia discretos, funcionava razoavelmente bem para átomos com poucos elétrons, como o hidrogênio. No entanto, ao tentar aplicá-lo a átomos com maior número atômico, surgiram inconsistências. Ele não conseguia prever com precisão os espectros de emissão de átomos polieletrônicos, ou seja, átomos com mais de um elétron. A interação eletrostática entre os múltiplos elétrons, não considerada de forma adequada no modelo, resultava em previsões espectrais incorretas.
A falta de uma explicação para a intensidade e a estrutura fina das linhas espectrais também demonstrava as limitações do modelo. Simplesmente, a estrutura orbital circular e os níveis de energia definidos não conseguiam capturar a complexidade da interação eletrônica em átomos mais complexos.
Contribuição do Modelo de Rutherford-Bohr para a Mecânica Quântica
Embora limitado, o modelo de Rutherford-Bohr foi um passo fundamental para o desenvolvimento da mecânica quântica. A introdução da quantização da energia, ou seja, a ideia de que os elétrons só podem ocupar níveis de energia específicos, foi uma ruptura com a física clássica e um conceito central para a mecânica quântica. A postulação de que os elétrons emitem ou absorvem energia em saltos quânticos ao mudar de nível energético explicava, pela primeira vez, os espectros de emissão discretos observados experimentalmente.
Essa quantização da energia, apesar de explicada de forma simplificada no modelo de Bohr, abriu caminho para modelos mais sofisticados, como o modelo atômico baseado na mecânica quântica, que incorpora princípios como a dualidade onda-partícula e o princípio da incerteza de Heisenberg.
Comparação com o Modelo Atômico Baseado na Mecânica Quântica
O modelo atômico atual, baseado na mecânica quântica, supera as limitações do modelo de Rutherford-Bohr ao descrever os elétrons não como partículas orbitando em trajetórias definidas, mas como ondas de probabilidade descritas por funções de onda. A localização de um elétron é, portanto, probabilística, representada por orbitais atômicos, regiões do espaço onde a probabilidade de encontrar o elétron é alta.
A mecânica quântica explica com sucesso os espectros atômicos complexos, a estrutura fina das linhas espectrais e outros fenômenos que o modelo de Bohr não conseguia explicar. Enquanto o modelo de Bohr fornece uma imagem simplificada e visualmente intuitiva, o modelo quântico oferece uma descrição mais precisa e completa, embora menos intuitiva, do comportamento dos átomos.
Representação Visual do Modelo de Rutherford-Bohr
Imagine um pequeno núcleo denso e positivo, como uma bola de bilhar, situado no centro de uma vasta arena. Este núcleo representa a maior parte da massa do átomo. Em torno dele, em órbitas circulares bem definidas e distantes do núcleo, encontram-se os elétrons, representados por pequenas esferas negativas, muito menores que o núcleo. As órbitas não são todas iguais; elas estão organizadas em camadas ou níveis de energia, com as órbitas mais próximas do núcleo possuindo energias mais baixas.
A proporção entre o tamanho do núcleo e a eletrosfera é extremamente desproporcional; se o núcleo fosse do tamanho de uma ervilha, a eletrosfera teria o tamanho de um estádio de futebol. Esta imagem, embora simplificada, ilustra a ideia central do modelo de Rutherford-Bohr: um núcleo denso e positivo com elétrons orbitando em níveis de energia discretos. A distância entre o núcleo e os elétrons é vastamente maior que o tamanho do próprio núcleo, destacando a maior parte do átomo como espaço vazio.
Falha na Explicação do Efeito Zeeman
O efeito Zeeman, que consiste na separação das linhas espectrais de um átomo quando submetido a um campo magnético externo, não pode ser explicado pelo modelo de Rutherford-Bohr. Este modelo não considera o momento angular intrínseco (spin) do elétron, nem a interação entre o momento magnético do elétron e o campo magnético externo. A mecânica quântica, com a inclusão do spin e do momento magnético orbital, explica satisfatoriamente o efeito Zeeman, fornecendo uma descrição precisa da interação entre o átomo e o campo magnético.
A ausência dessa explicação no modelo de Rutherford-Bohr demonstra mais uma vez suas limitações e a necessidade de um modelo mais completo, como o fornecido pela mecânica quântica.
Em resumo, o modelo atômico de Rutherford-Bohr, apesar de suas limitações, representa um marco crucial na história da ciência. Ele forneceu uma imagem mais refinada da estrutura atômica, introduzindo o conceito de níveis de energia quantizados e preparando o terreno para o desenvolvimento da mecânica quântica. Embora superado por modelos mais abrangentes, seu legado permanece como um passo fundamental na compreensão da matéria e sua complexa organização, demonstrando a evolução contínua do conhecimento científico e a busca incessante por uma descrição mais precisa do universo.

