Forças De Van Der Waals Exemplos são forças intermoleculares que desempenham um papel crucial na determinação das propriedades físicas e químicas de uma ampla gama de substâncias. Essas forças, que são mais fracas do que as ligações químicas, surgem da interação entre os momentos dipolares induzidos ou permanentes nas moléculas.
As forças de Van der Waals são responsáveis por fenômenos como a solubilidade, a adsorção e o ponto de ebulição de líquidos e sólidos.
Existem três tipos principais de forças de Van der Waals: forças de London, forças dipolo-dipolo e ligações de hidrogênio. As forças de London são as mais fracas e surgem da interação entre os momentos dipolares induzidos nas moléculas. As forças dipolo-dipolo são mais fortes e ocorrem entre moléculas polares que possuem momentos dipolares permanentes.
As ligações de hidrogênio são as mais fortes das forças de Van der Waals e envolvem a interação entre um átomo de hidrogênio ligado a um átomo eletronegativo e um par de elétrons não compartilhado em outro átomo eletronegativo.
Introdução às Forças de Van der Waals
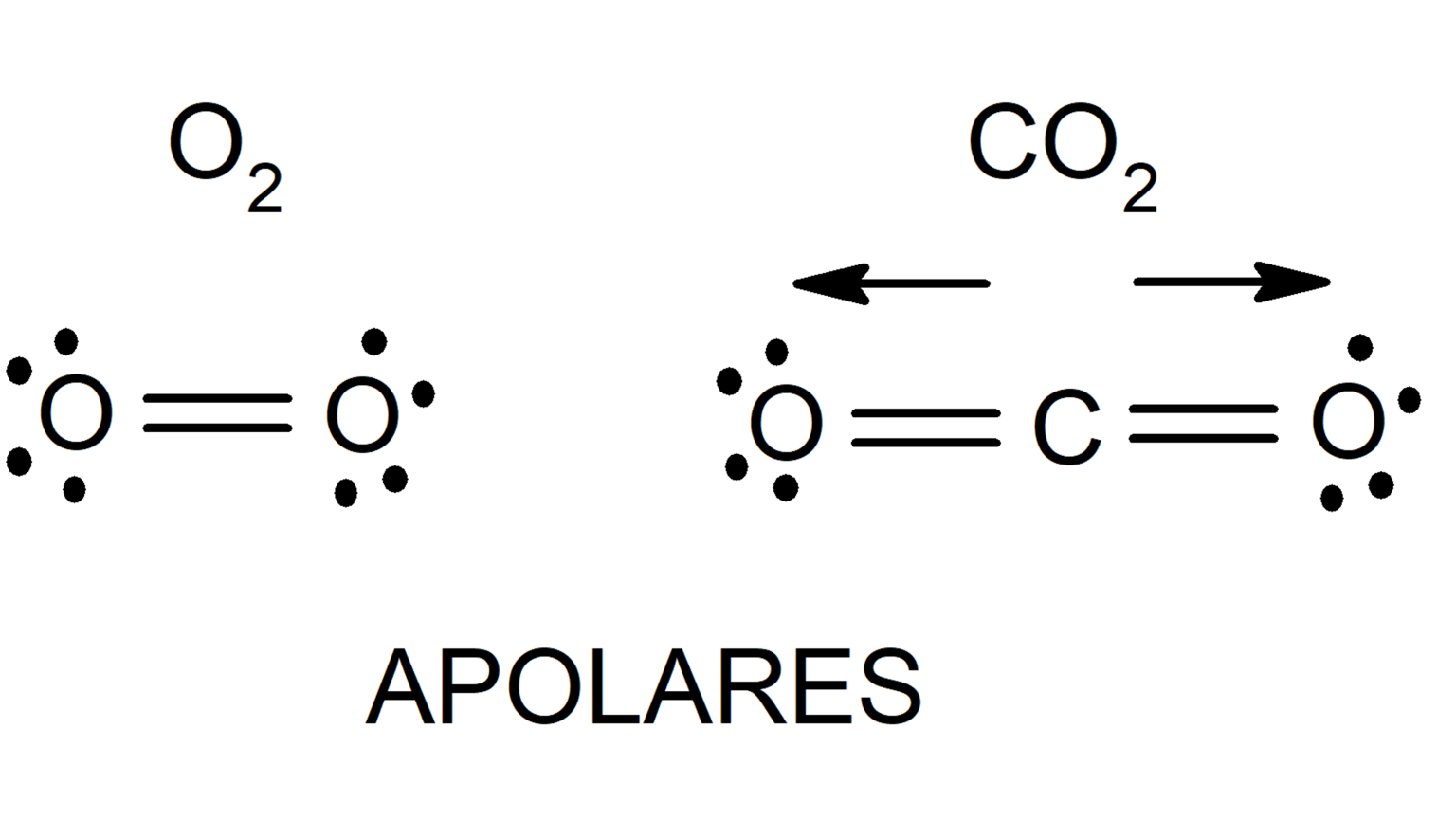
As forças de Van der Waals são forças intermoleculares fracas que surgem da interação entre moléculas. Essas forças são responsáveis por muitas das propriedades físicas das substâncias, como o ponto de fusão, o ponto de ebulição e a viscosidade.
As forças de Van der Waals são diferentes das ligações químicas, que são forças fortes que mantêm os átomos unidos em moléculas. As ligações químicas envolvem o compartilhamento ou transferência de elétrons, enquanto as forças de Van der Waals resultam de interações mais fracas entre as nuvens de elétrons de moléculas adjacentes.
Tipos de Forças de Van der Waals
Existem três tipos principais de forças de Van der Waals:
- Forças de London: Essas forças são as mais fracas e ocorrem entre todas as moléculas, mesmo as apolares. Elas surgem devido à flutuação temporária na distribuição de elétrons em uma molécula, criando um dipolo instantâneo que induz um dipolo temporário em uma molécula adjacente.
- Forças Dipolo-Dipolo: Essas forças ocorrem entre moléculas polares, que possuem um momento dipolar permanente devido à distribuição desigual de elétrons. Os polos positivos de uma molécula são atraídos pelos polos negativos de outra molécula.
- Ligações de Hidrogênio: Esse tipo de força é o mais forte entre as forças de Van der Waals e ocorre entre moléculas que possuem um átomo de hidrogênio ligado a um átomo eletronegativo, como oxigênio, nitrogênio ou flúor. O átomo de hidrogênio é atraído por um par de elétrons não compartilhado em outro átomo eletronegativo em uma molécula adjacente.
Forças de London
As forças de London, também conhecidas como forças de dispersão de London, são forças intermoleculares que surgem da interação entre dipolos temporários induzidos em moléculas. Essas forças são presentes em todas as moléculas, mesmo as apolares.
O mecanismo de indução de dipolos temporários é baseado na flutuação aleatória da distribuição de elétrons em uma molécula. Em qualquer momento, a nuvem de elétrons pode se deslocar para um lado da molécula, criando um dipolo instantâneo com um lado ligeiramente positivo e outro ligeiramente negativo.
Esse dipolo instantâneo pode então induzir um dipolo temporário em uma molécula adjacente, criando uma atração intermolecular.
A força das forças de London depende do tamanho e da forma da molécula. Moléculas maiores e mais polarizáveis têm forças de London mais fortes, pois suas nuvens de elétrons são mais facilmente distorcidas. Por exemplo, o butano (C 4H 10) tem um ponto de ebulição mais alto do que o propano (C 3H 8), pois o butano é uma molécula maior e mais polarizável.
Forças Dipolo-Dipolo
As forças dipolo-dipolo são forças intermoleculares que ocorrem entre moléculas polares. Moléculas polares possuem um momento dipolar permanente devido à distribuição desigual de elétrons, criando um lado da molécula com uma carga parcial positiva e outro lado com uma carga parcial negativa.
As forças dipolo-dipolo resultam da atração eletrostática entre os polos opostos das moléculas polares. O polo positivo de uma molécula é atraído pelo polo negativo de outra molécula, e vice-versa. Essas forças são mais fortes do que as forças de London, mas ainda são mais fracas do que as ligações de hidrogênio.
Por exemplo, o clorometano (CH 3Cl) é uma molécula polar devido à diferença de eletronegatividade entre o carbono e o cloro. As moléculas de clorometano interagem por meio de forças dipolo-dipolo, o que explica seu ponto de ebulição mais alto em comparação com o metano (CH 4), que é uma molécula apolar.
Ligações de Hidrogênio
As ligações de hidrogênio são um tipo especial de força intermolecular que ocorre entre moléculas que possuem um átomo de hidrogênio ligado a um átomo eletronegativo, como oxigênio, nitrogênio ou flúor. Essas ligações são as mais fortes entre as forças de Van der Waals e são responsáveis por muitas das propriedades únicas da água e de outras moléculas biológicas.
A ligação de hidrogênio ocorre devido à atração eletrostática entre o átomo de hidrogênio (com carga parcial positiva) e um par de elétrons não compartilhado em outro átomo eletronegativo em uma molécula adjacente. Essa atração é mais forte do que as forças dipolo-dipolo devido à alta eletronegatividade dos átomos de oxigênio, nitrogênio e flúor, que resultam em uma forte polarização da ligação H-O, H-N ou H-F.
Por exemplo, a água (H 2O) é uma molécula polar que forma ligações de hidrogênio com outras moléculas de água. Essas ligações de hidrogênio são responsáveis pelo alto ponto de ebulição da água, bem como por suas propriedades como solvente.
Importância das Forças de Van der Waals
As forças de Van der Waals desempenham um papel crucial nas propriedades físicas das substâncias. Elas influenciam o ponto de fusão, o ponto de ebulição, a viscosidade, a solubilidade e a adsorção. Essas forças também são importantes em muitos processos biológicos, como a formação de proteínas e a interação entre moléculas de DNA.
Influência nas Propriedades Físicas
As forças de Van der Waals influenciam diretamente as propriedades físicas das substâncias, como:
- Ponto de fusão: As forças de Van der Waals mais fortes resultam em um ponto de fusão mais alto, pois mais energia é necessária para superar essas forças e fazer com que a substância mude de estado sólido para líquido.
- Ponto de ebulição: Da mesma forma, um ponto de ebulição mais alto é observado em substâncias com forças de Van der Waals mais fortes, pois mais energia é necessária para superar essas forças e fazer com que a substância mude de estado líquido para gasoso.
- Viscosidade: A viscosidade de um líquido é uma medida de sua resistência ao fluxo. As forças de Van der Waals mais fortes resultam em uma viscosidade mais alta, pois as moléculas estão mais fortemente ligadas umas às outras.
Papel em Fenômenos Físicos
As forças de Van der Waals desempenham um papel importante em fenômenos como:
- Solubilidade: As forças de Van der Waals influenciam a solubilidade de uma substância em outra. Substâncias com forças de Van der Waals semelhantes tendem a ser mais solúveis umas nas outras. Por exemplo, o óleo, que é uma substância apolar, é mais solúvel em outros compostos apolares, como o hexano, do que em água, que é uma substância polar.
- Adsorção: A adsorção é o processo de adesão de moléculas de um fluido (gás ou líquido) à superfície de um sólido. As forças de Van der Waals desempenham um papel crucial na adsorção, pois são responsáveis pela atração entre as moléculas do fluido e a superfície do sólido.
Exemplos de Forças de Van der Waals
A tabela abaixo mostra exemplos de moléculas e os tipos de forças de Van der Waals presentes em cada uma delas:
| Molécula | Estrutura | Polaridade | Ponto de Ebulição (°C) | Forças de Van der Waals |
|---|---|---|---|---|
| Metano (CH4) | Tetraédrica | Apolar | -161,5 | Forças de London |
| Etano (C2H6) | Linear | Apolar | -88,6 | Forças de London |
| Clorometano (CH3Cl) | Tetraédrica | Polar | -23,8 | Forças de London, dipolo-dipolo |
| Água (H2O) | Angular | Polar | 100 | Forças de London, dipolo-dipolo, ligações de hidrogênio |
| Etanol (C2H5OH) | Linear | Polar | 78,4 | Forças de London, dipolo-dipolo, ligações de hidrogênio |
O diagrama a seguir ilustra a interação entre moléculas de água por meio de ligações de hidrogênio:
Aplicações das Forças de Van der Waals
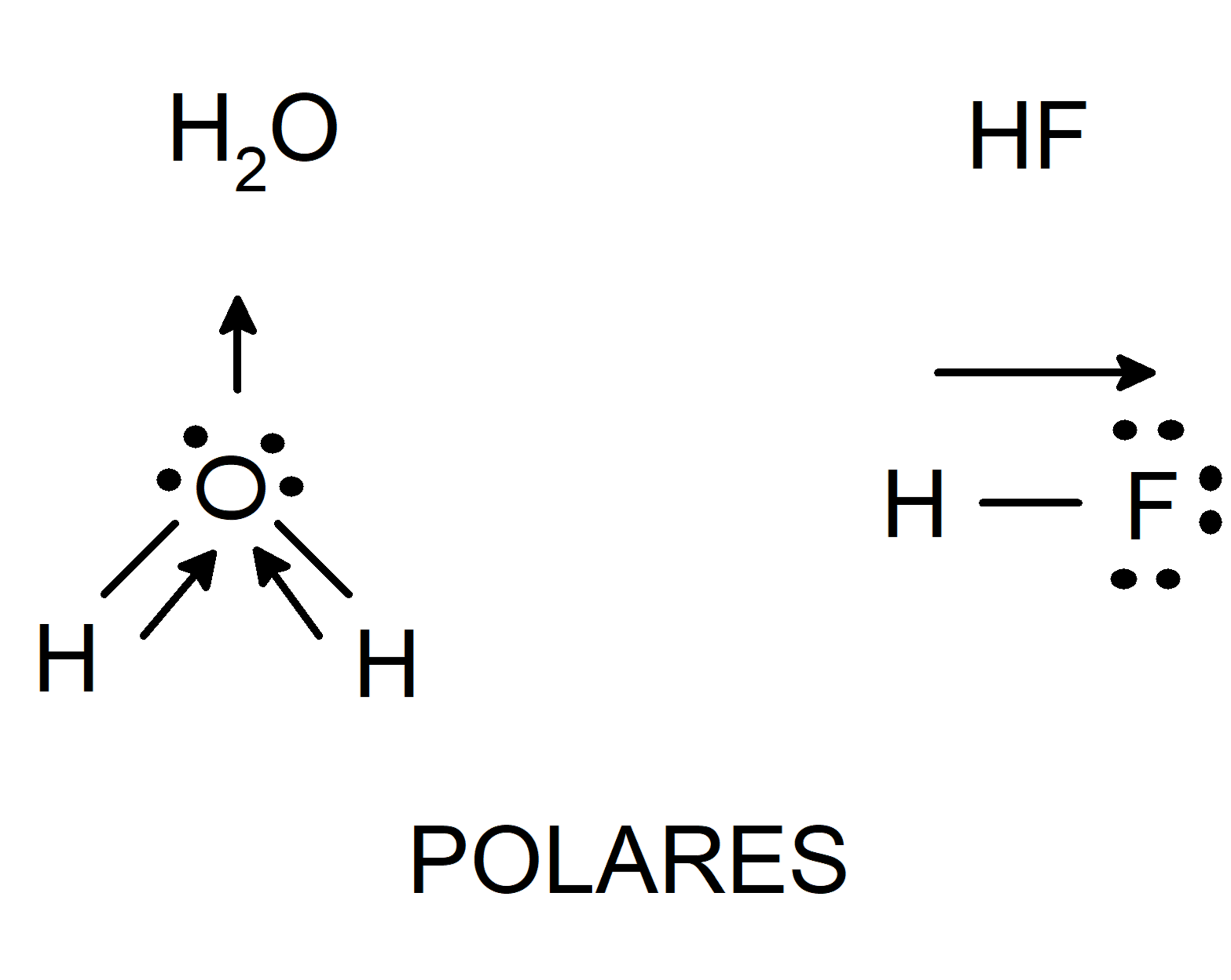
As forças de Van der Waals têm aplicações importantes em diversas áreas da ciência e tecnologia, incluindo:
- Materiais: As forças de Van der Waals são importantes para a estrutura e propriedades de muitos materiais, como polímeros e biomoléculas. Por exemplo, as forças de Van der Waals são responsáveis pela resistência e flexibilidade dos polímeros, bem como pela interação entre as cadeias de DNA.
- Cromatografia: A cromatografia é uma técnica de separação que utiliza diferentes propriedades físicas das substâncias para separá-las. As forças de Van der Waals desempenham um papel importante na cromatografia, pois são responsáveis pela interação entre as substâncias e a fase estacionária da coluna cromatográfica.
- Catálise: A catálise é o processo de acelerar uma reação química por meio de um catalisador. As forças de Van der Waals podem desempenhar um papel na catálise, pois podem influenciar a adsorção de reagentes na superfície do catalisador.
Common Queries: Forças De Van Der Waals Exemplos
Quais são os exemplos de moléculas que apresentam ligações de hidrogênio?
Moléculas que apresentam ligações de hidrogênio incluem água (H2O), amônia (NH3) e metanol (CH3OH). Essas moléculas possuem um átomo de hidrogênio ligado a um átomo eletronegativo (oxigênio, nitrogênio ou flúor) e podem formar ligações de hidrogênio com outras moléculas do mesmo tipo.
Como as forças de Van der Waals influenciam a viscosidade de um líquido?
As forças de Van der Waals influenciam a viscosidade de um líquido, pois afetam a capacidade das moléculas de se moverem umas em relação às outras. Quanto mais fortes forem as forças de Van der Waals, maior será a viscosidade do líquido, pois as moléculas serão mais fortemente atraídas umas pelas outras e terão mais dificuldade em se mover.

